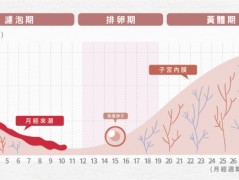
黄体期是女性月经周期中从排卵开始到月经开始结束的阶段。在此期间,卵泡会急剧转变为黄体,黄体会主要分泌黄体酮。黄体期激素环境的明显变化会改变子宫内膜的结构,使胚胎能够成功植入。如果没有健康的黄体期,植入就不可能发生,因此有效的黄体期缺陷治疗对于恢复健康的生育能力至关重要。
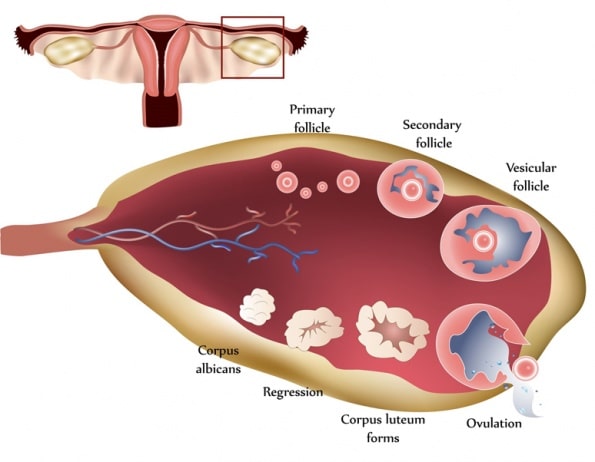
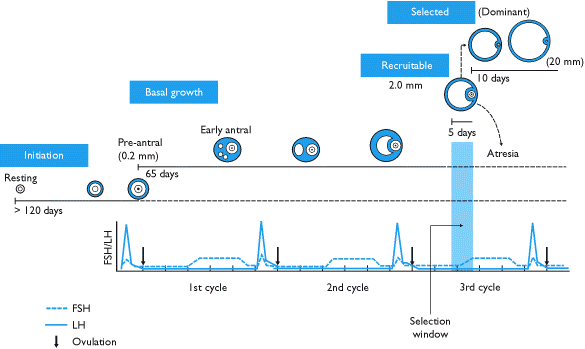
有一种误解认为卵泡会在一个月经周期中发育。虽然黄体期通常持续 2 周,但排卵和黄体形成是一段更长的准备期的顶峰。卵泡发生过程始于排卵前约 375 天,招募自出生以来一直处于休眠状态的原始卵泡。
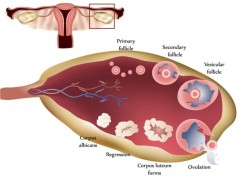
出生时,原始卵泡内有卵母细胞,周围环绕着颗粒细胞。卵泡一旦被招募,需要 300 多天才能完成前腔期,在此期间,颗粒细胞会复制,卵泡膜细胞会被招募。当这些卵泡最终到达它们一直在准备的 28 天周期开始时,它们将竞争促卵泡激素,成为优势卵泡。在周期的前 2 周,卵泡膜细胞会产生雄激素,颗粒细胞会将雄激素芳香化为雌激素。
在卵泡期,雌激素刺激子宫内膜细胞增殖。在黄体期,孕酮分化子宫内膜基质,增加腺体分泌,改变子宫蛋白模式,产生有利于早期胚胎发育的环境。孕酮还具有抗炎作用,并诱导子宫肌层松弛。
黄体的形成和黄体期
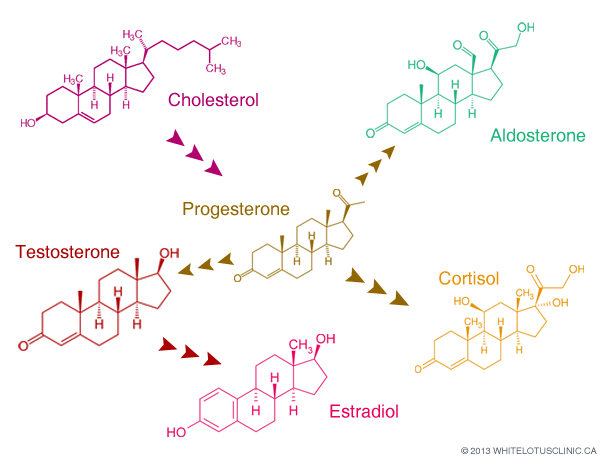
到卵泡期结束时,促黄体激素激增导致卵母细胞排出,并将剩余的卵泡转化为黄体;小黄体细胞和大黄体细胞分别由卵泡膜细胞和颗粒细胞形成。小黄体细胞分泌少量孕酮,并将胆固醇转化为雄激素。大黄体细胞产生的孕酮是卵泡膜细胞的 6 到 8 倍,并将雄激素芳香化为雌激素。
影响黄体细胞功能的因素
黄体细胞膜靠近毛细血管。这为黄体的高代谢提供了条件,黄体每单位重量消耗的氧气比肝脏、肾脏甚至心脏多 2 到 6 倍。可以想象,促进血液循环对于健康的黄体细胞激素产生至关重要。
孕酮的产生取决于黄体细胞中的线粒体功能和一系列激素因素。它还取决于其前体胆固醇和孕烯醇酮的可用性。专门支持黄体生长或功能的激素包括促黄体激素、生长激素 (GH)、胰岛素样生长因子 1、前列腺素 E 2和前列环素。
甲状腺和肾上腺功能及其与孕酮的关系
甲状腺功能对于卵泡的发育和生长至关重要。甲状腺激素与促卵泡激素协同作用,形成健康的颗粒细胞。甲状腺激素还被发现能增强颗粒细胞和大黄体细胞的类固醇生成。
肾上腺会产生少量的孕酮,主要用于合成皮质醇。在压力大的情况下,肾上腺会产生高水平的皮质醇,因此也需要更多的孕酮作为底物,但这不会直接影响排卵后的孕酮水平,因为这仅发生在肾上腺中。
但是,当压力很大时,可以通过大脑中的下丘脑下调排卵,从而完全阻止排卵。这种情况称为下丘脑性闭经,通过实验室测试很容易将其与病因区分开来。
诊断、体征和症状
我们可以使用多种诊断标记来检测黄体期不足。这些包括:
基础体温图表可以查明黄体期缺陷(<短于 12 天),这表明黄体过早退化。
基础体温图表可以检测出黄体期温度过早下降或不稳定。黄体期温度应该较高且稳定。如果不是,则表明黄体质量差或过早退化。
黄体期或月经开始前出现出血或点滴出血也表明黄体质量差或过早退化。
血清孕酮水平低(<20 ng/mL)或排卵后7天唾液孕酮水平低表明黄体细胞功能不佳。
还应完成皮质醇和全甲状腺检查。这些指标的异常会加重黄体期不足。
治疗 – 天然助孕剂
一般营养很重要。应采用全食饮食,包括大量优质蛋白质并避免激素干扰物。富含健康脂肪的食物,如鳄梨、坚果和种子、散养有机鸡蛋和特级初榨椰子油,可为类固醇激素提供前体。由于卵泡形成是一个长期过程,因此月经周期前一年的营养可能会影响黄体期。
整个周期中应给予的天然生育促进剂包括:
海岸松树皮提取物(每天 3 次,每次 50 毫克)可增强血液循环、减少凝血并增加 GH 以支持黄体功能。
维生素 B 6 已在临床上用于治疗黄体功能不全。它调节激素和孕酮受体的表达。 维生素 B 复合物支持肾上腺健康和应激反应,因此应每天服用高质量的复合物。添加吡哆醛-5-磷酸以达到 100 毫克/天的维生素 B 6。
褪黑激素(睡前服用 1.5-3 毫克)可增加孕酮生成并支持生长激素分泌。
维生素 C(750 毫克/天)可提高黄体期缺陷女性的孕酮水平,增强生育能力,并增强细胞健康。
由于黄体酮合成增加,黄体期需要增加甘氨酸镁(400 毫克/天)的摄入量。
Omega-3 脂肪酸(每日约 1200 毫克二十碳五烯酸和 800 毫克二十二碳五烯酸)对卵泡结构和功能以及激素产生至关重要。 研究发现,它们可直接增加孕酮分泌;它们通过增加前列环素与血栓素的比率来增强子宫和卵巢的血流量。
吡啶甲酸锌(30毫克/天)可增加胰岛素样生长因子 1 和 GH。锌缺乏可能会损害黄体的形成。
建议使用辅酶 Q 10 (800 毫克/天)或泛醇(300 毫克/天)来支持线粒体和内质网中的生物合成,从而促进细胞发育和功能。
仅在周期的黄体期给予的补充剂包括以下内容:
圣洁莓( 起床时每天服用 170 毫克 6:1 圣洁莓提取物)可促进孕酮生成。
如有指征,建议补充生物同质性黄体酮。血清黄体酮水平升高可改善黄体1的血流量 ,并促进子宫内膜的变化,从而支持植入。
如果有迹象表明,建议服用以下补充剂:
以高效甲状腺配方的形式提供甲状腺支持,包括 l-酪氨酸(1000 毫克/天)、硒(200 微克/天)和碘(450 微克/天),旨在将促甲状腺激素水平降至 2.5 mIU/L 或以下。在自身免疫性甲状腺炎的情况下避免使用碘。在某些情况下可能需要生物同质激素。
可能需要减轻压力和支持肾上腺。 根据 4 点皮质醇结果,考虑使用含有红景天、刺五加或腺体的肾上腺配方。
References:
Niswender GD, Juengel JL, Silva PJ, Rollyson MK, McIntush EW. Mechanisms controlling the function and life span of the corpus luteum. Physiol Rev. 2000;80(1):1-29.
Datta M, Roy P, Banerjee J, Bhattacharya S. Thyroid hormone stimulates progesterone release from human luteal cells by generating a proteinaceous factor. J Endocrinol. 1998;158(3):319-325.
Buz’Zard AR, Peng Q, Lau BH. Kyolic and Pycnogenol increase human growth hormone secretion in genetically-engineered keratinocytes. Growth Horm IGF Res. 2002;12(1):34-40.
Tully DB, Allgood VE, Cidlowski JA. Modulation of steroid receptor–mediated gene expression by vitamin B6. FASEB J. 1994;8(3):343-349.
Taketani T, Tamura H, Takasaki A, et al. Protective role of melatonin in progesterone production by human luteal cells. J Pineal Res. 2011;51(2):207-213.
Durotoye LA, Webley GE, Rodway RG. Stimulation of the production of progesterone by the corpus luteum of the ewe by the perfusion of melatonin in vivo and by treatment of granulosa cells with melatonin in vitro. Res Vet Sci. 1997;62(2):87-91.
Nassar E, Mulligan C, Taylor L, et al. Effects of a single dose of N-acetyl-5-methoxytryptamine (Melatonin) and resistance exercise on the growth hormone/IGF-1 axis in young males and females. J Int Soc Sports Nutr. 2007;4:14. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2174513/?tool=pubmed. Accessed June 15, 2012.
Henmi H, Endo T, Kitajima Y, Manase K, Hata H, Kudo R. Effects of ascorbic acid supplementation on serum progesterone levels in patients with a luteal phase defect. Fertil Steril. 2003;80(2):459-461.
Facchinetti F, Borella P, Valentini M, Fioroni L, Genazzani AR. Premenstrual increase of intracellular magnesium levels in women with ovulatory, asymptomatic menstrual cycles. Gynecol Endocrinol. 1988;2(3):249-256.
Zachut M, Dekel I, Lehrer H, et al. Effects of dietary fats differing in n-6:n-3 ratio fed to high-yielding dairy cows on fatty acid composition of ovarian compartments, follicular status, and oocyte quality. J Dairy Sci. 2010;93(2):529-545.
Coyral-Castel S, Ramé C, Fatet A, Dupont J. Effects of unsaturated fatty acids on progesterone secretion and selected protein kinases in goat granulosa cells. Domest Anim Endocrinol. 2010;38(4):272-283.
Saldeen P, Saldeen T. Women and omega-3 fatty acids. Obstet Gynecol Surv. 2004;59(10):722-730.
Yu ZP, Le GW, Shi YH. Effect of zinc sulphate and zinc methionine on growth, plasma growth hormone concentration, growth hormone receptor and insulin-like growth factor–I gene expression in mice. Clin Exp Pharmacol Physiol. 2005;32(4):273-278.
Hamza RT, Hamed AI, Sallam MT. Effect of zinc supplementation on growth hormone insulin growth factor axis in short Egyptian children with zinc deficiency. Ital J Pediatr. 2012;38(1):21. http://www.ijponline.net/content/38/1/21/abstract. Accessed June 15, 2012.
Bentinger M, Tekle M, Dallner G. Coenzyme Q: biosynthesis and functions. Biochem Biophys Res Commun. 2010;396(1):74-79.
Ibrahim NA, Shalaby AS, Farag RS, Elbaroty GS, Nofal SM, Hassan EM. Gynecological efficacy and chemical investigation of Vitex agnus-castus L. fruits growing in Egypt. Nat Prod Res. 2008;22(6):537-546.
Bergmann J, Luft B, Boehmann S, Runnebaum B, Gerhard I. The efficacy of the complex medication Phyto-Hypophyson L in female, hormone-related sterility: a randomized, placebo-controlled clinical double-blind study [in German]. Forsch Komplementarmed Klass Naturheilkd. 2000;7(4):190-199.











还没有评论,来说两句吧...